MSC来源的sEVs的治疗应用

间充质干细胞是干细胞家族的重要成员,来源于发育早期的中胚层,属于多能干细胞,间充质干细胞在体内或体外特定的诱导条件下具有多向分化潜能,可用于衰老和病变引起的组织器官损伤修复。但现在越来越多的研究发现,间充质干细胞的功能作用主要是由旁分泌因子介导的。此外,很多证据表明,MSCs通过释放胞外囊泡(EVs)发挥许多大部分的旁分泌作用,特别是Small EVs(直径50-200nm),sEVs可以从不同培养条件培养的MSCs培养上清中获得,很多文献报道其具有很好治疗效果。因此,MSC-sEVs被认为是很有前途的治疗药物,并被推荐用于临床试验。但是,MSC-sEVs的来源和分离方法具有多样性,需要有明确的验证的指标和功能分析来更好地制备标准的MSC-sEV。
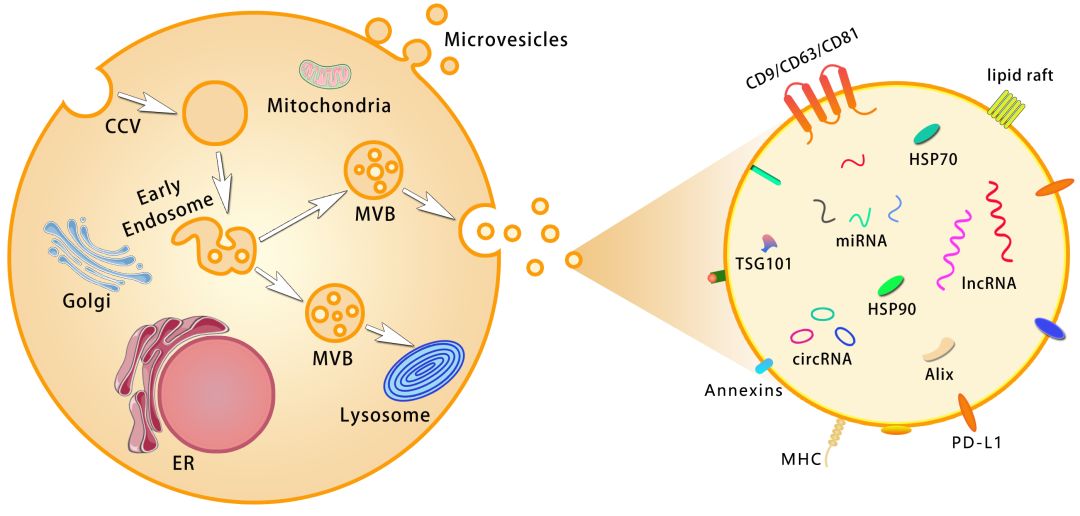
将MSC-sEVs实现临床转化的关键是MSC,MSC已经在临床中进行了大量的试验,并已证明其安全性。迄今为止,已有近1000项临床试验被注册,包括骨髓(BM)、脂肪组织(AD)、脐带血(CB)等来源的MSC。然而,到目前为止,只有少数MSC产品被批准上市。这可能与某些临床试验中没有观察到明显的治疗效果以及不同实验室制备的MSC产品的异质性有关。为了推进间充质干细胞在治疗领域的发展,国际细胞与基因治疗学会(ISCT)将人间充质干细胞的基本特征提炼为一套最低的建议标准。

*第一:MSC在标准培养条件下保持贴壁。
*第二:MSC必须表达CD105、CD73和CD90,并且不表达CD45、CD34、CD14或CD11b、CD79alpha或CD19和HLA-DR表面分子。
*第三:MSC必须能够在体外向成骨细胞、脂肪细胞和成软骨细胞分化。
ISCT对MSC的定义是非常有用的,可以作为界定MSC的参考标准,然而,这些标准仅仅代表了一个基本的定义,它更多的是用来消除非MSC的细胞,而且,这些基本参数是在2006年建立的,没有包含MSC的治疗效力相关的生物活性、作用机制等内容,比如免疫调节、抑制纤维化、促进邻近细胞的增殖或EVs的释放等。根据最初的标准,很难预测间充质干细胞的治疗效力,所以需要进行更多的研究,以丰富MSC的定义标准。

越来越多的人认识到,在不同的临床应用中,MSCs的生物学活性会有所不同,因此,我们应该更多的关注其生物活性,而不是传统的标准。为MSCs定义细胞类型不同于定义sEVs的来源。例如,长时间培养MSCs可能会破坏其分化潜能,但不会损害其衍生的sEVs的治疗效果。所以如果要证明MSC为MSC-sEVs的细胞来源,需要的最少信息包括:
证明MSC-sEVs的最少信息:
*(1)分离MSCs的组织来源说明(CB、AD、BM)。
*(2)确认三种谱系潜能中至少一种,要区分MSC与成纤维细胞,成纤维细胞具有许多间充质干细胞的特征,但似乎缺乏治疗活性。
*(3)源细胞需要注明 (原代或经修饰的MSC)。
*(4)最后的MSC-sEVs制剂的功能测试,以确定MSC是否有能力产生功能性sEVs。

EV通常包括为外泌体、微囊泡及凋亡小体等囊泡,对于外泌体还没有一个严格的定义。外泌体通常指由内体形成的一类特殊的sEV,不同于从质膜上以出芽的形式分泌的EV(微囊泡、微粒子)。虽然外泌体通常被认为比微囊泡小,但这两种EV类型不能仅根据大小来区分,因为它们各自的大小范围是有重叠的。所以要制备一个纯的MSC-sEVs制剂,需要一套完整分离和鉴定方案,才能排除掉非内体来源囊泡的干扰。
由于目前还无法利用EV的生物生成对EV进行分离,因此外泌体的命名比较推荐使用sEVs这个术语,sEVs也源于最近提出的根据物理特性或分离方法对EV进行分类的建议。例如,经过0.22um过滤器或100000xg超速离心获取的EV通常直径小于200nm,可归类为sEVs。虽然这样分类提供很少EV的生物学信息,但它很实用,因为它定义了一个可以进行制备的EV种群。因此可以使用MSC small EVs (MSC-sEVs),来描述由MSC释放的,直径为50-200nm的,双层膜囊泡。
MSC-sEVs生产的过程是MSC-sEV制剂标准化的主要考虑因素。要想实现MSC-sEVs临床应用,一个GMP级的生产过程是非常必要的。生产步骤的选择取决于所需要的批量大小,并且sEVs的纯度、一致性、安全性和稳定性等评价指标,必须通过质量测试并加以确认。

生物反应器培养:
在细胞培养中,细胞密度可影响细胞行为和分泌物的性质。据报道,在较低密度下接种的细胞,细胞会产生更多的sEVs。所以为了能够大规模生产MSC-sEV,生物反应器是很理想的设备。目前有三种主要的生物反应器类型,每一种都对生产MSC-sEVs产生独特的影响:
2D表面的生物反应器
基于中空纤维的生物反应器
搅拌罐生物反应器 (必须在微载体上培养MSC)
虽然三种生物反应器都已用于MSC制备,但它们对sEV生产及功能的影响需要进一步研究。即使细胞在静态下的培养条件完全成熟,也不能立马转移到生物反应器中,必须要再优化培养条件。3D生物反应器更有利于MSC的培养,因为它可以监测细胞数量、生存能力、形态和增殖,并提供更均匀的营养和氧气的分布。
细胞培养基成分:
MSC在胎牛血清(FBS)为能量来源的培养基中很容易生长,但是,为了促进MSC-EV在治疗应用的发展,至少应该在sEV生产制备阶段消除异种成分。因此,可以用人血清或血小板裂解液(hPL)来替代FBS。但与FBS一样,人血清和hPL本身都含有EV或EV样颗粒,它们可以与MSCs产生的sEVs共同被纯化。这些外源性EVs可能是安全的,因为富含EVs的输血产品大都是安全。但事实上,目前尚无证据表明hPL-EV对MSC-EV制剂的治疗作用是否负性影响,而且外源性的sEVs或非sEVs颗粒可能会降低或阻断MSC-sEVs的某些作用。因此,确定外源性囊泡与MSC-sEVs在治疗作用上的关系是非常有必要的。

超速离心法:
超速离心法是目前应用最广泛的EV富集方法。然而,超离心法有几个缺点。超离心法不能产生高纯度的sEVs,虽然系列洗涤可以提高纯度,但同时也会降低产量。有报道称超离后的sEV有聚集的现象,影响其电镜下的形态。最重要的是,超速离心由于仪器的限制,不能高通量提取,且费时费力。所以超速离心不可能对MSC-sEV进行大规模纯化。
商业试剂盒提取
近年来,随着EV研究领域的发展,针对EV的商业产品数量激增。虽然这些产品中的一些已被认可,甚至潜在的符合GMP,但对许多产品来说,分离方法的原理并没有被阐明,而且一些专有试剂的成分也不为人所知。除非产品的原理及操作已证明符合GMP要求,且商业试剂盒供应商披露了专有试剂成分,并评估该成分的临床可用性和安全性,否则使用此类试剂盒生产临床级的sEVs是不现实的。
聚乙二醇聚合物沉淀:
用聚乙二醇(PEG)或其他聚合物“盐析”沉淀是减少样本体积,达到浓缩目的的有效方法,而且样本处理量很大,一次可以提取几升细胞上清的EV,且操作简单,只需要低速离心就可以获得大量的EV,但是,聚乙二醇沉淀的EV中含有大量的共沉淀物,PEG沉淀不能获得纯净的EV。然而,PEG-沉淀的MSC-sEVs已经用于临床研究,PEG浓缩的MSC-sEVs在缺血性脑卒中模型中的作用与相应的MSC效果相同。因此,PEG沉淀似乎不会干扰MSC-sEV活性。
依据颗粒大小分离:
基于EV粒径大小的分离方法,如尺寸排阻色谱法(SEC)和切向流过滤法(TFF),被越来越受到研究人员的认可。与传统方法相比,这些方法更容易实现,同时还可以生产高纯度的EV和而且不影响其生物活性,所以SEC和TFF被认为是高产高效的EV提取方法,其生产流程更容易标准化,适合GMP级的EV的生产。

我们目前对MSC-sEVs的定义仅仅传达了EV的特性和生物完整性,并不能预测其治疗效果。因此,开发一系列可定量、可靠的能够预测MSC-EVs治疗效力的的指标是十分必要的。检测MSC-sEV的治疗活性也需要对MSC-sEV生物学有深入的了解,例如正常和病变状态下MSC-sEVs的半衰期和体内生物分布,以及对不同组织的直接或间接靶向等内容。因此,定义MSC-sEV制剂的治疗效能需要更深层次的讨论,这也是SOCRATES、ISCT、ISEV和ISBT未来探索的主题。
文章来源:
Defining mesenchymal stromal cell (MSC)-derived small extracellular vesicles for therapeutic applications. Journal Extracellular Vesicles. 2019
